
前言
在进行自噬研究时,WB 检测 LC3-I 和 LC3-II 几乎是必做的实验,那么,进行 LC3 检测时,需要注意哪些要点呢?你的实验方案真的没有问题吗?下面我们来具体看一下实验方案的设计易错点。
LC3: 从何处来?往何处去?
LC3/Atg8 被具有蛋白内切酶活性的 Atg4 在羧基端剪切,生成胞质 LC3-I。LC3-I 通过 Atg7 和 Atg3(分别对应 E1 和 E2 样酶)参与的泛素样反应,使 PtdEth(PE) 偶联,生成脂质化形式的 LC3,也称作 LC3-II,它可以附着到自噬体 (autophagosome) 的膜上,是自噬体的结构蛋白。在降解过程中,位于自噬溶酶体外膜的 LC3-II 被半胱氨酸蛋白酶 Atg4B 移除后回收,位于内膜的 LC3-II 则与包裹的内容物一起,被溶酶体降解。
LC3A/B/C 有种属细胞/组织分布特点
LC3/Atg8 被具有蛋白内切酶活性的 Atg4 在羧基端剪切,生成胞质 LC3-I。LC3-I 通过 Atg7 和 Atg3(分别对应 E1 和 E2 样酶)参与的泛素样反应,PtdEth(PE) 偶联,生成脂质化形式的 LC3,也称作 LC3-II,它可以附着到自噬体 (autophagosome) 的膜上,是自噬体的结构蛋白。在降解过程中,位于自噬溶酶体外膜的 LC3-II 被半胱氨酸蛋白酶 Atg4B 移除后回收,位于内膜的 LC3-II 则与包裹的内容物一起,被溶酶体降解。
哺乳动物 LC3 蛋白的四个亚型(LC3A, LC3B,LC3B2 和 LC3C),他们的表达因组织或细胞类型而异。如图 2 所示,在甲状腺(Thyroid,第一行)中,LC3B 的表达水平并不高,检测 LC3A 更为合适。所以,需要根据自己使用的细胞系或者组织的情况,使用合适的靶标抗体。当然,通过使用抗 LC3A/B 抗体,同时检测 LC3A 和 LC3B,可以大大增加实验的成功率。
LC3 的来去是一个动态过程——检测 PCR 意义并不大,做 wb 也不能只简单检测就了事
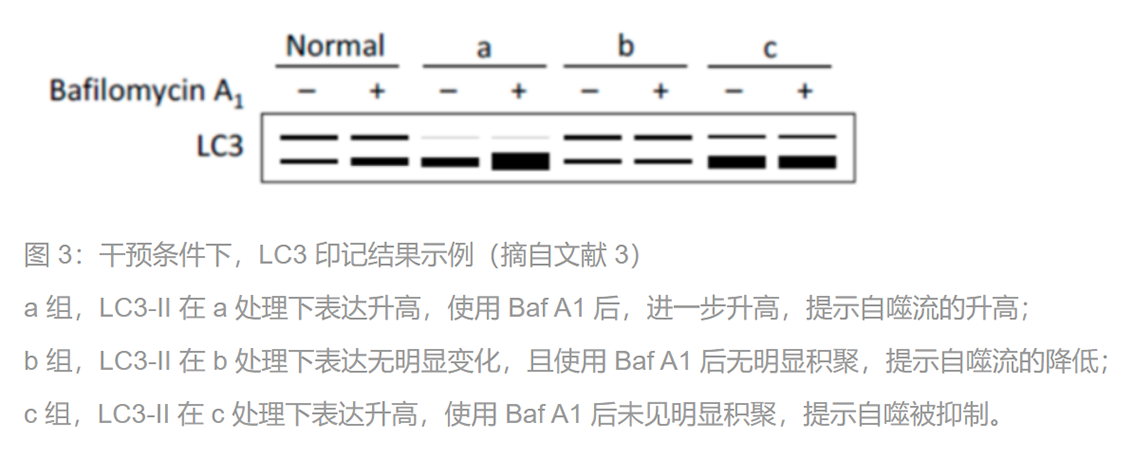
正如前言所述,LC3-I 和 II 存在一个生成-降解的动态过程。自噬小体有一个生成、融合、降解的过程,即「自噬流」。所以,单时间点 LC3-II 的表达改变并不能体现自噬的改变,需要使用一些阻断溶酶体降解的药物(如氯喹、巴佛洛霉素 A1 等),判断在干预手段下,细胞的自噬程度的改变。氯喹可以通过抑制溶酶体功能(比如升高它的 pH 值),抑制 LC3-II 的降解;巴佛洛霉素 A1 则是一种强效 V-ATPase 抑制剂,阻断溶酶体依赖的降解。在「堵漏」的前提下,根据一段时间内 LC3-II 的积聚程度,判断自噬的改变(图 3)。
LC3 检测的注意点
目前的 LC3 抗体所检测的抗原表位都位于 LC3 的 N 端,由于 PE 基团结合可能导致 N 端区域的构象变化,使得抗体对 LC3-II 的亲和性更高,所以 LC3-II 条带显色深并不能代表该样本处于高自噬状态。另外,LC3-I 对反复冻融更为敏感,也更易在 SDS 上样缓冲液中降解。基于以上两个原因,在半定量时,除了使用 LC3-II/LC3-I 的比值外,也有科学家使用 LC3-II 与管家蛋白(Housekeeping Protein)的比值进行半定量。
LC3 是一个膜相关蛋白
作为脂化和膜相关蛋白,在细胞裂解后,对其进行冰上短暂超声,促进蛋白的溶解,将 LC3 从膜上解离。
超声方法:使用 35%-40% 的 功率进行 3 次超声脉冲,每次超声时间 10 秒, 每次超声之间停顿 10 秒,不同的仪器可以调整 功率水平在 200W 左右。
如没有细胞超声仪,可使用 1 mL 注射器(带针头),通过反复抽吸的方式达到类似于超声的效果。
LC3-I 和 LC3-II 是小分子蛋白
LC3-I 的分子量约 16KD,由于 LC3-II 接合了 PE 基团,所以理论上,LC3-II 的分子量比 LC3-I 更高。但是,由于带负电的 PE 改变了 LC-II 的性质,使其疏水性更强,导致其在电泳中迁移率更高,所以,LC3-II 在电泳后,停留在了更小分子量(约 14KD)处。
小分子量、LC3-I 与 LC3-II 仅有 2KD 差异,在 WB 中需注意:
· 使用高浓度分离胶(~15%,确认 Tris 缓冲液的 pH 值)进行分离;
· 转膜时,使用小孔径 0.22um 转印膜,湿转 70V 1.5 h 即可。对于半干转(如 Trans-Blot Turbo System),则可使用 2.5A 7 min。
自噬是一个「流动」的过程,目前,检测自噬流的方法有很多,除了 Western blot 外,还有电镜、长寿命蛋白降解实验,mRFP-GFP-LC3 双荧光系统等等,每一种实验方法都有其优缺点,所以,需根据实验目的选择合适的实验方法,或者使用多个实验方法进行交叉论证,才能得到可靠的结论。